Une nouvelle « cachette » pour les souches d'Acinetobacter
Acinetobacter baumannii est une bactérie opportuniste particulièrement problématique dans les hôpitaux en raison de souches résistantes aux antibiotiques de dernier recours. A. baumannii possède une forte capacité d’adhésion aux surfaces et aux équipements médicaux ainsi qu’à nos cellules. Dans cette étude publiée dans la revue mSystems, les scientifiques montrent que certaines souches sont très invasives et établissent une sorte de « cachette » au sein des cellules infectées, rendant permissive la multiplication bactérienne.
La bactérie Acinetobacter baumannii est une bactérie nosocomiale opportuniste qui touche particulièrement les personnes hospitalisées en soins intensifs ou de longue durée (par exemple sous ventilation mécanique, avec des traumatismes ou grands brûlés). Les souches d'A. baumannii multirésistantes aux antibiotiques sont associées à une morbidité et une mortalité importante dans les hôpitaux du monde entier. Pour cette raison, A. baumannii est classée comme prioritaire par l'Organisation mondiale de la santé (OMS) pour le développement d'antimicrobiens. Il est donc essentiel de comprendre leur pathogénicité pour améliorer la prise en charge thérapeutique.
L'un des traits de virulence d’A. baumannii est sa résistance à la dessiccation et aux désinfectants, ainsi que sa capacité à adhérer à toutes les surfaces, formant souvent des communautés bactériennes appelées biofilms. De façon similaire, A. baumannii adhère à nos cellules au cours de l’infection, mais seule une petite proportion des bactéries envahit les cellules tout en présentant une survie limitée. Dans cette étude, les scientifiques, mettent en évidence une nouvelle « cachette » pour certains isolats cliniques d’A. baumannii. Ces derniers sont capables d’envahir et d’établir une niche spécialisée au sein de nos cellules, permettant une multiplication importante des bactéries sans que cela induise la mort cellulaire.
Ce compartiment intracellulaire permettrait à A. baumannii d'échapper à la voie de dégradation normale de la cellule, protégeant ainsi les bactéries des réponses immunitaires de l'hôte et entravant potentiellement l’efficacité des antibiotiques. Cela pourrait contribuer à la persistance d'A. baumannii, à la récurrence des infections et à la mortalité accrue chez les patients sensibles. Un criblage par microscopie à haut débit effectué dans cette étude a confirmé que cette capacité de multiplication intracellulaire est présente dans d'autres isolats cliniques d'A. baumannii, dont certains sont à l'origine de récentes épidémies à forte mortalité.
La découverte d'une niche intracellulaire ainsi que d'isolats très invasifs d'A. baumannii devra désormais être prise en compte pour le développement de nouveaux outils de diagnostic et de thérapies.
 © Tristan Rubio & Charline Debruyne
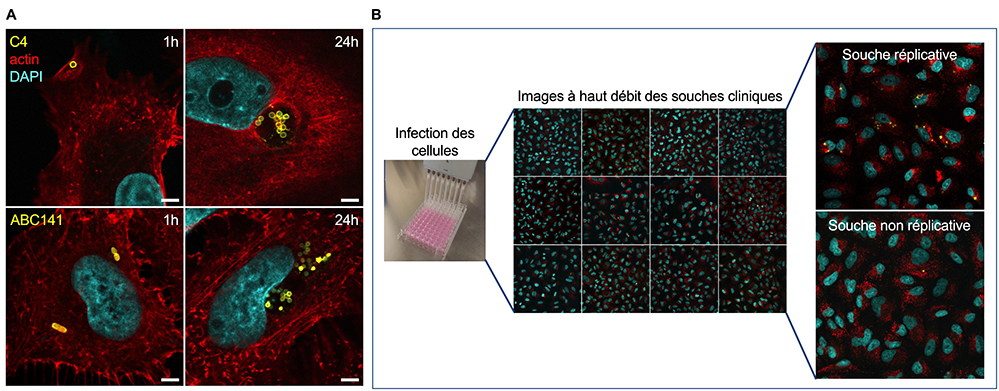
© Tristan Rubio & Charline DebruyneFigure : Mise en évidence de la capacité de multiplication intracellulaire de certaines souches cliniques d’Acinetobacter baumannii multirésistantes aux antibiotiques. (A) Image par microscopie confocale à immunofluorescence de cellules épithéliales pulmonaires humaines (rouge) infectées par deux isolats cliniques différents d’A. baumannii nommés C4 (image en haut) et ABC141 (image en bas), se multipliant à l'intérieur des cellules en formant des agglomérats de bactéries (jaune) à proximité des noyaux (bleu). (B) Criblage par microscopie à haut débit de plus de quarante souches d'A. baumannii mettant en évidence l'existence de certaines très invasives et plusieurs avec la capacité de se multiplier au sein des cellules.
Pour en savoir plus :
Incidence of an Intracellular Multiplication Niche among Acinetobacter baumannii Clinical Isolates
Tristan Rubio , Stéphanie Gagné , Charline Debruyne , Chloé Dias , Caroline Cluzel , Doriane Mongellaz, Patricia Rousselle, Stephan Göttig, Harald Seifert, Paul G Higgins, Suzana P Salcedo
mSystems 22 février 2022. DOI: https://doi.org/10.1128/msystems.00488-21


